|
|
Órgão Oficial de Divulgação Científica da
|
ISSN: 1679-1796
|
Cicatrização da Miotomia Esofagiana por Acesso Videolaparoscópico Com e Sem Plicatura Gástrica Associada, em Porcos
Wound Healing of Laparoscopic Oesophageal Myotomy With and Without an Added Gastric Patch, in Pigs
João Luiz Moreira Coutinho Azevedo, Fábio Okutani Kozu, Albino Augusto Sorbello, Otávio Azevedo, Francisco Julimar Correia de Menezes
Trabalho realizado no Laboratório do Setor de Videocirurgia da Disciplina de Técnica Operatória e Cirurgia Experimental
(TOCE), Departamento de Cirurgia da Universidade Federal de São Paulo (UNIFESP), Programa de Pós-Graduação em Cirurgia e Experimentação
OBJETIVO: Comparar a cicatrização da miotomia esofagiana laparoscópica associada ou não à plicatura
gástrica. MATERIAL E MÉTODOS: Foram utilizados doze porcos, em dois grupos de seis animais. No grupo A foi
realizada miotomia esofagiana. No grupo B agregou-se plicatura gástrica à região da miotomia (RM). No 21° dia pós-operatório houve
sacrifício do animal e moldagem do lume esofagiano para determinação do índice de estenose (IE) na RM. Foram também estudados
aspectos macroscópicos da cicatrização. Foi feita biópsia da parede esofagiana na RM. RESULTADOS: Duração cirúrgica maior no grupo B
(93,6 minutos) que no grupo A (45 minutos). Considerando-se o IE dos grupos A
e B, não houve estenose e eles se equivaleram (-11.1%
no grupo A e -12.7% no grupo B). Houve regularidade da cicatrização da RM do grupo A e deformidades com inflamação aguda
persistente e granulomas no grupo B. No grupo A houve epitelização mesotelial da superfície cruenta da RM e no grupo B esta
permaneceu granulada. Na RM do grupo B os elementos da inflamação foram mais numerosos que no grupo A: média de 22 leucócitos
versus 8,6; de 18,7 vasos neoformados
versus 9,7; e de 25,85 fibras colágenas versus 15,6. CONCLUSÕES: A plicatura gástrica sobre a
miotomia esofagiana propicia cicatrização menos adequada e a intervenção é mais demorada que a miotomia isolada. Com ou sem
plicatura gástrica associada, a continuidade da musculatura esofagiana não se refaz após miotomia e o lume esofagiano é ampliado na
região da incisão.
Palavras-chave: Videocirurgia; Laparoscopia; Técnicas operatórias; Acalasia esofagiana; Miotomia
de Heller; Fundocardioplastia de Dor; Miotomia esofagiana; Cirurgia experimental; Cirurgia
minimamente invasiva; Cirurgia endoscópica.
AIMS: The purpose of this research is to compare the wound healing of the laparoscopic esophageal myotomy
with and without a gastric patch. METHODS AND MATHERIAL: Twelve male pigs were distributed into two groups of
six animals. Esophageal myotomy was performed in group A. A gastric patch was associated to esophageal myotomy in group B. On
the 21st postoperative day, lumen molding was accomplished to determine the index of stenosis (IS) at the area of myotomy
(AM). Macroscopic and microscopic aspects of wound healing were also studied at AM. Three microscopic morphologic patterns
were defined for morphometric evaluation: leucocytes (constituted by polymorphonuclear and mononuclear cells), de novo formed
vessels and intercellular substance (collagen fibers). RESULTS: There was a longer operative duration in group B (93. 6") than in group
A (45"). At AM, IS was negative (lumen increased) and equivalent in both groups: -11.1% in group A and -12.7% in group B.
Mesotelial epithelium covering RM was observed in group A. Inflammatory reaction was greater in group B in comparison with group
A (leucocytes: 22 cells versus 8.6; fibrosis: 25.5 fibers versus 15.6; granulation tissue: 18.7 vessels versus 9.7).
CONCLUSIONS: Esophageal myotomy followed by gastric patch does not heal adequately and is worsened by the presence of foreign body
granulomas around stitches. Myotomy without gastric patch is faster and causes lower inflammation. Myotomy alone or with gastric patch do
not lead to esophageal stenosis at RM and do not lead to restoration of the esophageal musculature continuity.
Key words: Laparoscopy; Laparoscopic, surgery; Surgery, operative; Esophageal achalasia;
Laparoscopic Heller myotomy; Dor's Fundoplication; Esophagomyotomy; Cirurgia experimental; Surgery,
minimally invasive; Surgery, endoscopic.
|
Azevedo JLMC, Kozu FO, Sorbello AA , Azevedo O, Menezes FJC. Cicatrização da Miotomia Esofagiana por Acesso Videolaparoscópico Com e Sem Plicatura Gástrica Associada, em Porcos. Rev bras videocir 2004;2(4):177-183. |
||
|
Recebido em 09/11/2004 |
|
Aceito em 20/11/2004 |
recomendação da associação de
plicatura gástrica sobre a zona cruenta da
miotomia esofagiana reporta-se à cirurgia
convencional1. Nesse universo alega-se que, além de prevenir
o refluxo gastresofagiano iatrogênico, o fundo
gástrico plicado sobre a zona cruenta _
tamponando perfurações inadvertidas do esôfago e
interpondo-se entre as bordas da ferida, evitaria
fatores determinantes da recidiva da acalasia. Um
destes fatores - a estenose, poderia se seguir à
fibrose periesofagiana, induzida por escapes do
conteúdo visceral oriundos de eventuais
minúsculas perfurações iatrogênicas de mucosa
esofagiana passadas despercebidas2,3; o outro fator _
a reconstituição do mecanismo esfinctérico
intrínseco esofageano inferior, conseqüente à coaptação
entre si das bordas da musculatura esofagiana
dividida na miotomia2,3. Também no âmbito da
cirurgia videolaparoscópica adotam-se esses
argumentos, entre outros, para justificar a aposição de
plicatura gástrica à
miotomia4.
Por outro lado, há autores que postulam
ser deletéria a plicatura do fundo gástrico sobre
a miotomia, pois isso dificultaria a reabsorção
do exsudato inflamatório, cuja permanência
conduziria ao aumento da fibrose na
região5,6. Caso expostas em peritônio livre, essas coleções seriam
prontamente absorvidas, propiciando epitelização da zona
cruenta por células mesoteliais do líquido
peritoneal5,6. Também a magnificação do campo
operatório videocirúrgico poderia evidenciar
microperfurações iatrogênicas que _ identificadas mediante teste
de injeção de azul de metileno e gás, não teriam
como passar despercebidas5,6. Adicionalmente, o tônus
da camada circular da musculatura esofagiana seccionada tenderia a condicionar o afastamento,
uma da outra, das bordas da miotomia, de forma a
não haver risco de sua
coaptação5,6.
A hipótese aqui testada é a de que
a superfície cruenta resultante da miotomia
esofagiana laparoscópica, permanecendo exposta na
técnica sem válvula associada, é epitelizada por
células mesoteliais livres no líquido peritoneal,
resultando em excelente reparo da miotomia, com
manutenção adequada do afastamento das bordas
musculares secionadas no procedimento.
MATERIAIS E MÉTODOS
Foram utilizados 12 porcos machos da
raça Landrace, com peso corpóreo entre 15 a
20kg, distribuídos aleatoriamente em grupo A
(miotomia isolada) e grupo B (miotomia associada a
plicatura gástrica).
Os animais foram operados sob anestesia inalatória, intubados e colocados sob pressão
positiva intermitente Para a indução anestésica, os
animais receberam 12 mg/kg de thiopental intravenoso.
A anestesia foi mantida com isoflorane a 2% em vaporização e citrato de fentanila 0,005 mg/kg
em infusão intravenosa. No pós-operatório
imediato receberam cetoprofeno por via intravenosa na
dose de 2mg/kg.
O estudo foi aprovado pelo comitê de
ética em pesquisa experimental da Universidade
Federal de São Paulo - UNIFESP/EPM.
O acesso operatório utilizado foi
o videolaparoscópico em todos os animais, através
de cinco portais, em posição usual para o acesso
à junção esôfago-gástrica.
Após abertura do ligamento gastrofrênico
e demarcação a bisturi elétrico da localização
da miotomia, incisou-se a face anterior do
esôfago numa extensão de 5cm acima do esfíncter
inferior, interessando as túnicas musculares.
Nos animais do grupo B foi interposto um segmento da parede anterior do fundo
gástrico, plicado sobre a superfície cruenta da miotomia
e fixado às bordas da musculatura
esofagiana seccionada mediante seis pontos simples de
Poliéster 3-0, sendo três em cada borda da
miotomia. Naqueles do grupo A foi dispensado este reparo.
A eutanásia ocorreu no 21o dia
pós-operatório sendo realizado exame macroscópico seguido
de retirada do segmento esofagiano de 20 cm de comprimento, abrangendo a região da
miotomia (RM), moldado mediante injeção (no lume
da víscera) de 60 ml de solução de
hidrocolóide irreversível, composta de diatomita, alginato
de potássio, sulfato de cálcio, carbonato de magnésio
e corantes. O molde foi retirado do lume esofágico,
após endurecimento, para a determinação dos índices
de estenose (IE) da RM, sendo mensurados os
perímetros externos do molde ao nível de RM (A), das
regiões correspondentes a 2cm craniais (B) e a 2cm
caudais (C) em relação às extremidades longitudinais
da miotomia. Destas três medidas foi obtido o IE,
segundo a fórmula (McADAMS7): IE=100 (1_2A/B+C).
Foram retiradas amostras da parede esofagiana na RM para exame histopatológico.
As lâminas foram coradas pelos métodos
Hematoxilina-Eosina e tricrômico de Masson. Três
padrões morfológicos microscópicos foram definidos para
fins de avaliação morfométrica: leucócitos
(constituído por células polimorfonucleadas e células
mononucleadas), vasos neoformados e
substância intercelular (fibras colágenas).
Fixou-se em 5% (p = 0,05) o nível
de rejeição da hipótese de nulidade, assinalando-se
com um asterisco os valores significantes.
Empregou-se os métodos estatísticos constantes nas legendas
das tabelas.
RESULTADOS
Os animais de ambos os grupos não apresentaram sinais de dificuldade evidente
na deglutição dos alimentos ou qualquer outro
sinal clínico que pudesse levar a acreditar que os
mesmos tivessem alguma alteração do trânsito do
bolo alimentar pelo esôfago.
A média de duração das
intervenções operatórias no grupo com miotomia isolada
(grupo A) foi significantemente menor (45 minutos)
que no grupo B (93 minutos) que recebeu plicatura gástrica associada (Tabela 1).
Tabela 1 - Duração em minutos das intervenções operatórias dos grupos A e B.
| Grupo A | Grupo B |
| 60 | 80 |
| 50 | 140 |
| 50 | 75 |
| 50 | 77 |
| 25 | 90 |
| 35 | 100 |
| 45 | 93,67 |
| Teste t para grupos independentes
(Grupo A x Grupo B) Tempo das intervenções operatórias em minutos t calc.= 43,3* (P<0,05) tcrít.=0,08 B>A |
|
O aspecto macroscópico na região
da miotomia nos animais do grupo A era regular e evidenciava ausência de fibrose detectável a
olho nu (Figura 1), enquanto que nos animais do
grupo B notava-se fibrose profusa (Figura 2).
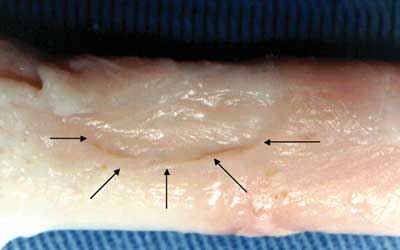 |
| Figura 1 - Fotografia da região miotomizada - setas (grupo A), constatando-se depressão acentuada no local da incisão cirúrgica do esôfago, com superfície regular e de aspecto nacarado. |
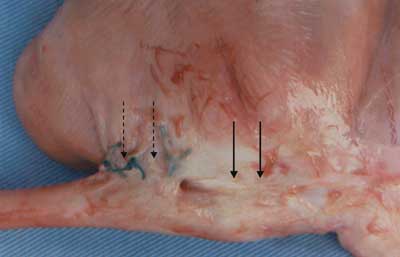 |
| Figura 2 - Fotografia de plicatura gástrica sobre a região da miotomia (grupo B), evidenciando fios de sutura (setas pontilhadas) e profusa fibrose envolvendo a transição esôfago-gástrica (setas contínuas). |
No estudo histológico qualitativo
dos animais do grupo A, notou-se processo
inflamatório discreto e ausência da túnica muscular do
esôfago na região da miotomia. A camada muscular
do esôfago foi substituída por tecido de
reparação, recoberto por células mesoteliais de
revestimento (Figura 3).
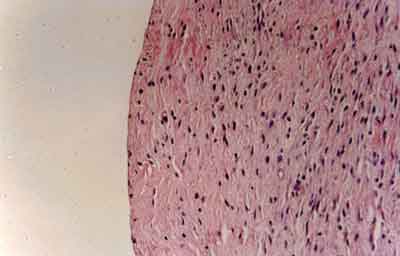 |
| Figura 3 - Fotomicrografia de aspecto histológico da superfície da miotomia em animal do grupo A, evidenciando recobrimento completo da zona cruenta por células mesoteliais. (HE _ 120 x) |
Nos animais do grupo B foi encontrado, na microscopia, intenso infiltrado linfoplasmocitário
no local da miotomia, com tecido de granulação
rico em capilares, leucócitos (linfócitos,
neutrófilos), plasmócitos, macrófagos e fibras colágenas, não
se notando epitelização por células mesoteliais
(Figura 4). Em muitas preparações histológicas dos
animais deste grupo, granulomas de corpo estranho circundando fios de sutura puderam ser observados.
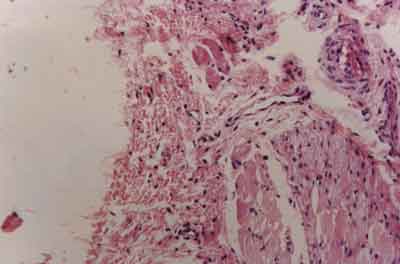 |
| Figura 4 - Fotomicrografia de aspecto histológico da superfície da miotomia em animal do grupo B, evidenciando tecido de granulação e com ausência de epitelização mesotelial. (HE _ 120 x) |
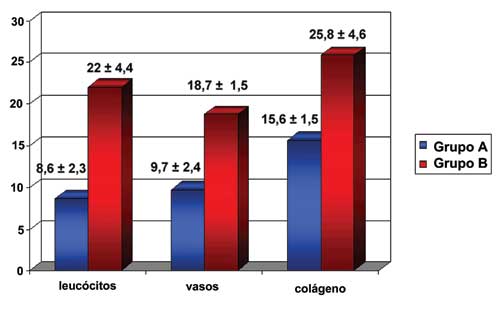
A análise estatística demonstrou que
os elementos da inflamação considerados no
estudo morfométrico (leucócitos, vasos neoformados e
fibras colágenas) foram significantemente mais
numerosos (Gráfico 1) após miotomia com plicatura
gástrica (grupo B) que com a miotomia isolada (grupo A).
 |
||||||||||||
| Teste t de Student
(Grupo A x Grupo B) t crítico=204 |
||||||||||||
|
||||||||||||
| Gráfico 1- Representação gráfica do número dos elementos da inflamação contados em 20 lâminas de cada grupo, com as respectivas médias e desvios-padrão, sendo os elementos contados no grupo com plicatura gástrica (grupo B) significantemente mais numerosos que os do grupo com miotomia isolada (grupo A). O asterisco (*) assinala o t calculado (t calc.) para uma probabilidade de 5% (P<0,05) de que as diferenças encontradas (B>A) entre os grupos em relação contagem dos elementos da inflamação terem sido devidas ao acaso. |
Os índices de estenose na região
da miotomia (IE) foram sempre negativos e
estatisticamente equivalentes entre os grupos
estudados (Tabela 2), indicando que houve aumento
idêntico da amplitude do lume do esôfago tanto na
região onde foi realizada a miotomia isolada quanto
na região da miotomia com adição da plicatura gástrica.
Tabela 2 - Índices de estenose na região da miotomia (IE) dos grupos A e B.
|
GRUPO A IE |
GRUPO B IE |
|
| - 4,76 | - 6,74 | |
| - 5,31 | -13,20 | |
| -11,76 | -12,22 | |
| -18,96 | -28,57 | |
| -14,28 | - 8,10 | |
| -11,60 | - 4,76 | |
| Médias | -11,1 | -12,7 |
|
Teste t para grupos independentes Grupo A x Grupo B Tcalc. = 1,0 (P<0,05) Tcrit. = 17,5 A = B |
||
DISCUSSÃO
A propósito da pertinência ou não
da associação de procedimento anti-refluxo à
miotomia esofagiana laparoscópica no tratamento da
acalásia, há autores que julgam imprescindível a aposição
de plicatura gástrica na superfície cruenta da
miotomia8-17, enquanto outros entendem poder dispensar
a associação de qualquer procedimento
anti-refluxo à miotomia laparoscópica, em casos
selecionados, com bons resultados18-22.
A propósito deste tema, recente
metanálise (LYASS23 e col.,
2003) concluiu: "Baseados nos
dados publicados, não podem ser feitas recomendações
no sentido da adição de procedimento anti-refluxo
à miotomia de Heller
laparoscópica."
Quanto à adequação que a plicatura
gástrica associada à miotomia traria à cicatrização da
região da miotomia, impedindo escapes e
evitando coaptação das bordas da incisão muscular, a
presente pesquisa pretendeu contribuir para o
esclarecimento da forma mediante a qual o reparo da
superfície cruenta da miotomia esofagiana se processa
na presença de duas circunstâncias distintas:
deixada livre na cavidade peritoneal ou recoberta por
fundo gástrico plicado sobre ela, como na técnica de
DOR1.
Nesta pesquisa pretendeu-se testar a hipótese de que a superfície cruenta da
miotomia esofagiana - deixada cicatrizar sem a
interferência do fundo gástrico plicado sobre ela, tende
a apresentar pequeno processo inflamatório e a
receber a epitelização regular das células
mesoteliais, oriundas da diferenciação e proliferação de
células mesenquimais primitivas que existem livres
no líquido peritoneal, conforme sói acontecer
nas superfícies cruentas em geral banhadas por
esse líquido.
No sentido de elidir eventual
interferência no processo cicatricial da parede esofagiana
inferior induzida pelo refluxo gastroesofagiano que
pode ocorrer após secção do esfíncter inferior do
esôfago, optamos por poupá-lo. Dessa forma, praticamos
a miotomia esofagiana mediante uma incisão longitudinal cuja extremidade caudal situava-se
a três centímetros cranialmente à transição
esôfago-gástrica.
Há autores que referem recidiva da
acalásia por causa da reconstituição do esfíncter inferior
do esôfago em função da coaptação entre si das
bordas da miotomia2,3. Entretanto, depreende-se da
análise da casuística desses autores que não houve
uma nítida diferenciação histopatológica entre
o refazimento do esfíncter inferior do esôfago e
a estenose por estreitamento extrínseco do
esôfago distal, mercê de fibrose.
A observação macroscópica e
microscópica da região da miotomia dos animais operados
nesta pesquisa mostrou que não houve reconstituição
do esfíncter, em nenhum dos dois grupos,
contrariando assim a opinião de alguns
autores2,3.
Nesta pesquisa, o índice de estenose
(IE) representa o percentual de redução do
lume esofágico. Quando o IE é igual a cem,
equivale-se à estenose total, e quando igual a zero, significa
não haver nenhuma estenose.
Nessa ordem de idéias, pudemos constatar que todos os índices de estenose da região
da miotomia nesta pesquisa foram negativos (Tabela 2), o que equivale a dizer que a miotomia
propiciou um aumento do lume do órgão no local. Dessa
forma, este experimento não sustentou a teoria
do refazimento da continuidade da musculatura esofagiana após miotomia sem plicatura
gástrica aposta. A razão desse fenômeno pode
ser compreendida se atentarmos para o fato de que
o componente circular da túnica muscular do
esôfago, o mais interno, ao ser completamente
seccionado na miotomia, tende - mercê do seu tônus natural
- a afastar uma da outra as bordas da miotomia,
dessa forma elidindo a sua coaptação. Foi
constatada, ainda, a perfeita cicatrização da miotomia
sem válvula (Figuras 1 e 3).
Por outro lado, a miotomia com plicatura gástrica (grupo B) também não evidenciou
estenose no local - IE negativo (Tabela 2).
Tudo isso aponta para a conclusão de que os relatos dos
autores2,3, que referem estenose esofagiana após miotomia, provavelmente
dizem respeito a secções do esfíncter inferior do
esôfago originariamente incompletas e não a
uma coaptação entre si das bordas de uma
miotomia completa.
Não obstante, obviou-se nesta pesquisa
que a adição do fundo gástrico plicado sobre a
superfície cruenta produz processo inflamatório de
grande magnitude e também maior quantidade de
fibrose _ grupo B (Figura 2, Gráfico 1) do que o
processo cicatricial resultante da miotomia isolada _
grupo A (Figura 1, Gráfico 1).
Finalmente, mas não menos
importante, ficou claramente evidenciado que a epitelização
da zona cruenta da miotomia isolada se fez de
forma regular e constante em todos os animais do
grupo A. Isso significa que o processo cicatricial
resultou numa reconstituição adequada da
superfície esofagiana (Figura 1).
É interessante observar que a
recomendação de se apor serosa gástrica sobre a superfície
cruenta da miotomia foi feita por
autores2,3 sem que nenhuma pesquisa em animais de experimentação
tivesse comprovado a hipótese do refazimento
da continuidade da musculatura do esôfago
inferior após miotomia caso a superfície cruenta seja
deixada aberta. É óbvio que apenas a experimentação
animal, ensejando a retirada do órgão em tempo
oportuno para exame histopatológico completo e
conclusivo, permitiria comprovar tal hipótese.
Enfatize-se aqui que a presente pesquisa
é a primeira experiência a ser feita com
características tais que poderia ter surpreendido
aspectos histopatológicos compatíveis com coaptação
entre si das bordas musculares da miotomia.
Entretanto, isso não ocorreu. Ao contrário, parece ter
sido cabalmente demonstrado que a continuidade da musculatura esofagiana não se refaz após
miotomia. Torna-se necessário rever o argumento antigo.
Novas pesquisas nessa mesma direção serão
bem-vindas. Quem sabe um mito tenha começado a ruir.
CONCLUSÃO
Na miotomia associada a plicatura
gástrica há prolongamento na duração de
fenômenos inflamatórios agudos, o que não ocorre na
miotomia isolada.
A plicatura gástrica sobre a miotomia esofagiana propicia processo inflamatório crônico
mais exuberante que o que ocorre na miotomia isolada.
O processo inflamatório crônico da
miotomia associada a plicatura gástrica é agravado
pela presença de granulomas de corpo estranho em
torno dos fios de sutura, o que não ocorre na
miotomia isolada.
A miotomia isolada apresenta
epitelização mesotelial da superfície cruenta, o que não
ocorre com a miotomia associada a plicatura gástrica.
Não há reconstituição da continuidade
da musculatura esofagiana na região da mitomia
isolada nem na miotomia com segmento gástrico
plicado sobre a superfície cruenta, no período observado.
Tanto a miotomia isolada quanto a associada a plicatura gástrica determina aumento da
amplitude do lume esofagiano ao nível da superfície cruenta.
A duração das intervenções com miotomia
associada é significantemente maior que a da miotomia isolada.
Agradecimentos
Agradecemos o suporte financeiro que nos concedeu o Fundo de Auxílio aos Docentes e Alunos (FADA) da Universidade Federal de São Paulo _ Escola Paulista de Medicina e os equipamentos e materiais laparoscópicos que nos foram cedidos pela PCE _ Pró-Cirurgia Especializada Ltda.
Referências Bibliográficas
1. Dor J, Humbert P, Dor V, Figarella J - L'intérêt de
la technique de Nissen modifiée dans la prévention
du reflux après cardiomyotomie extra-muqueuse de
Heller. Mém Acad Chir 1962;88:877-884.
2. Pinotti HW, Felix VN, Domene CE, Purceli
EL. Recurrence of dysphagia in patients operated on
for megaesophagus: analysis of determining factors.
Chir Gastroenterol 1979;13:1-7.
3. Ellis H, Gibb SP. Reoperation after esophagomyotomy
for achalasia of the esophagus. Am J Surg 1975;129:407-12.
4. Rosati R, Fumagalli U, Bona S, Bonavina L, Pagani
M, Perachia A. Evaluating results of laparoscopic surgery
for esophageal achalasia. Surg Endosc 1998;12:270-3
5. Azevedo JLMC, Boulez J. Comparison
between laparoscopic esophagocardiomyotomy with and
without antireflux procedure in the treatment of achalasia.
Surg Endosc 2001; 15(Suppl 1):S54
6. Boulez J, Meeus P, Espalieu P. Oesocardiomyotomie
de Heller sans anti-reflux par voie laparoscopique:
analyse d'une série de 27 cas. Ann Chir 1997;51:232-6.
7. McAdams AJ, Meikle AG, Taylor JO. One layer or
two layer colonic anastomoses? Amer J Surg
1970;120:546-50
8. Bloomston M, Boyce W, Mamel J, Albrink M, Murr
M, Durkin A et al. Videoscopic Heller´s myotomy for
achalasia _ results beyond short-term follow-up. J Surg
Res 2000;92:150-2.
9. Collard JM, Romagnoli R, Lengele B, Salizzoni
M, Kenstens PJ. Heller _ Dor procedure for achalasia:
from conventional to video-endoscopic surgery. Acta
Chir Belgium 1996;96:62-5.
10. Delgado F, Bolufer JM, Martínez-Abad M, Martín
J, Blanes F, Castro C et al. Laparoscopic treatment
of esophageal achalasia. Surg Laparosc Endosc
1996;6:83-90.
11. Dempsey DT, Kalan MMH, Gerson RS, Parkman
HP, Maier WP. Comparison of outcomes following open
and laparoscopic esophagomyotomy for achalasia.
Surg Endosc 1999;13:747-50.
12. Hunter JG, Trus TL, Branum GD, Waring JP.
Laparoscopic Heller myotomy and fundoplication for achalasia.
Ann Surg 1997;225:655-64.
13. Mitchell PC, Watson DI, Devitt PG, Briten-Jones
R, MacDonald S, Myers JC et al. Laparoscopic cardiomyotomy with a Dor patch for achalasia. Can
J Surg 1995;38:445-8.
14. Patti MG, Pellegrini CA, Horgan S, Arcerito
M, Omelanczuk P, Tamburini A et al. Minimally
invasive surgery for achalasia: an 8-year experience with 168
patients. Ann Surg 1999;230:587-93.
15. Peracchia A, Rosati R, Bona S, Fumagalli U, Bonavina
L, Chella B. Laparoscopic treatment of functional
diseases of the esophagus. Int Surg 1995;80:336-40.
16. Raiser F, Perdikis G, Hinder RA, Swanstrom LL,
Filipi CJ, McBride PJ et al. Heller myotomy via
minimal-access surgery: an evaluation of antireflux
procedures. Arch Surg 1996;131:593-7.
17. Yamamura MS, Gilster JC, Myers BS, Denevey
CW, Sheppard BC. Laparoscopic Heller myotomy and
anterior fundoplication for achalasia results in a high
degree of patient satisfaction. Arch Surg 2000;135:902-6.
18. Richards WO, Sharp KW, Holzman MD. An
antireflux procedure should not routinely be added to a
Heller myotomy. J Gastrointes t Surg 2001;5:13-6.
19. Wang PC, Sharp KW, Holzman MD, Clements
RH, Holcomb GW, Richards WO. The outcome of laparoscopic Heller myotomy without antireflux
procedure in patients with achalasia. The Am Surg 1998;64:515-21.
20. Igci A, Müslümanoglu M, Dolay K , Yamaner S,
Asoglu O, Avcic C. Laparoscopic esophagomyotomy
without an antireflux procedure for the treatment of achalasia.
J Laparoendosc Adv Surg Tech, 1998, 8(6), 409-416.
21. Robertson GS, Lloyd DM, Wicks AC, Caestecker
S, Veitch PS. Laparoscopic Heller´s cardiomyotomy
without an antireflux procedure. Br J Surg, 1995,
82():957-959.
22. Kjellin AP, Granqvist S, Ramel, Thor KBA.
Laparoscopic myotomy without fundoplication in patients with
achalasia. Eur J Surg, 1999, 165():1162-1166.
23. Lyass S, Thoman D, Steiner P, Phillips E. Current
status of an antireflux procedure in laparoscopic Heller
myotomy. Surg Endosc 2003;17(4):554-8.
ENDEREÇO PARA CORRESPONDÊNCIA
João Luiz M. C. Azevedo
Universidade Federal de São Paulo - Setor de Videocirurgia - Prédio da Cirurgia Experimental
Rua Botucatu, 740 _ V. Clementino
CEP 04023-900, São Paulo - SP
Telfax: 11 5576-4272
E-mail: jozevedo.dcir@epm.br
Site: http://www.cirurgiaonline.med.br
